吸收利来国际ag旗舰厅胰岛素不必依赖注射方式,只需随身携带口服药,长期以来为万千糖尿病患者所期盼。
糖尿病是以高血糖为特征的代谢性疾病,因为患者体内胰岛素分泌不足、胰岛素抵抗等原因引起血糖调节功能受损,必须使用外源胰岛素治疗。其中,口服胰岛素使用方便、患者依从性好,却很难克服胃肠道严苛的三重屏障,临床上尚未实现应用。
近日,国际期刊《ACS Nano》刊登了浙江大学爱丁堡大学联合学院周民研究员团队与浙江大学医学院附属第二医院严盛教授的科研成果。该研究利用绿色营养源食品小球藻吸附胰岛素,并用海藻酸钠凝胶包裹,制成微藻-胰岛素复合口服递送系统,在小鼠实验中保护胰岛素“突围”,在肠道内实现响应性药物释放。
?
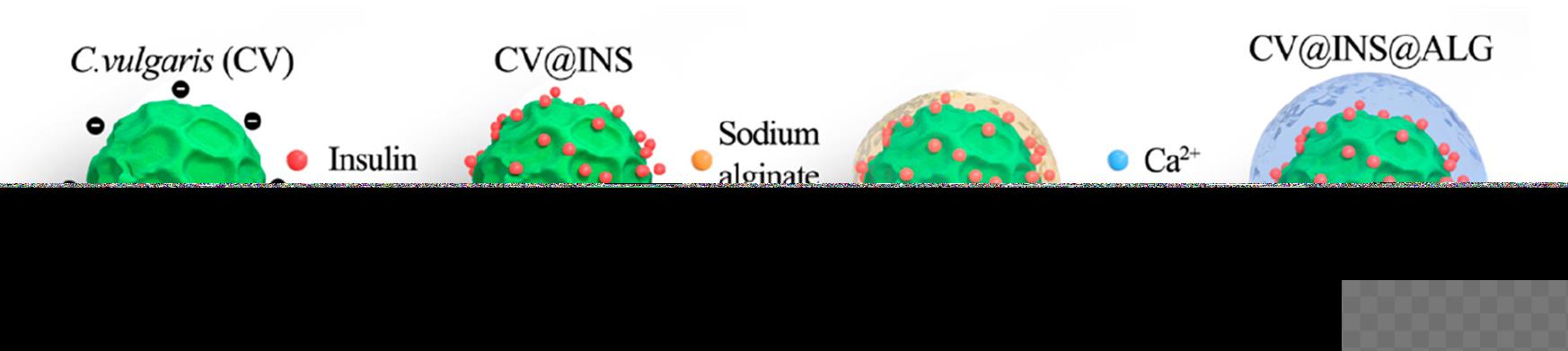
胰岛素吸附于小球藻后被海藻酸钠凝胶包裹
“微藻中含有蛋白质、脂类、藻多糖等营养成分和化工原料,广泛存在于海洋或淡水湖,在食品、保健品及燃料等领域多有应用。”周民介绍,微藻可以利用表面结构或非共价静电相互作用运载药物。该项研究团队已开展4年,前期筛选多种不同类型微藻对胰岛素的负载能力时发现小球藻效果最佳,决定对小球藻系统进行深层次的研究。
注射给药存在诸多不便
国际糖尿病联盟(IDF)2021年发布的第10版《IDF全球糖尿病地图》显示,彼时全球有5.37亿成年人患有糖尿病,较前两年增加了16%(7400万);中国有1.41亿成年人患有糖尿病,约占国内成年人口总数的13%。
然而,糖尿病并非只针对成年人,主要分1型与2型。浙大二院内分泌科副主任医师康英秀介绍,1型糖尿病是儿童期最常见的慢性疾病之一,也有病例发生于成人。其主要病因是产生胰岛素的胰岛β细胞遭到破坏导致胰岛素缺乏。
临床上大多数糖尿病患者所患的是2型糖尿病,由遗传和环境因素共同作用形成,患者通常因摄入高糖膳食过多导致胰岛素需求增加,从而产生胰岛素抵抗,或受体细胞对胰岛素缺乏敏感性,使血糖无法被及时处理。两种糖尿病类型均会引发多种并发症。
当人体自身分泌的胰岛素不足以控制血糖,需要外源胰岛素作为“外援”。
“目前胰岛素的给药方式主要为皮下注射或者是静脉给药。”该论文第一作者、浙江大学博士生任超杰介绍,很多患者需要每天注射,但注射方式的缺点很明显,比如准备工作太多、胰岛素需要在冰箱冷藏、注射剂量应适时调整、有些患者还有针头恐惧。
在副作用方面,长期在同一部位注射胰岛素的患者,皮下脂肪容易萎缩或脓肿;患者注射部位可能出现红肿、瘙痒、荨麻疹、血管神经性水肿;注射剂量过大,会使血糖迅速下降,引发饥饿、眩晕和四肢麻木等症状。
1921年,加拿大科学家首次发现并提纯了胰岛素,使糖尿病得以攻克。1965年,我国科学家成功合成结晶牛胰岛素,这也是世界上首个人工合成的蛋白质。如今,科学家们致力于让胰岛素更高效、便捷地治疗糖尿病患者,正开展鼻腔、口腔、肺部给药等多种非侵入给药途径的研究。
口服胰岛素面临三道屏障
通常情况下,口服药通过食道进入胃肠道,会经消化液溶解,被小肠绒毛吸收进入血液和淋巴系统,随着血液循环到达人体全身。
由于胰岛素是由多个氨基酸合成的肽类物质,属于蛋白质类激素,分子量大、易受酶降解、渗透性低,经口服渠道参与全身循环之前需要闯过化学、酶、渗透三道屏障,即胃肠道内复杂多变的酸碱环境,消化系统包含的多种蛋白酶以及在渗透环节中因肠道上皮细胞紧密排列产生的狭窄通道与杯状细胞创造的黏膜屏障。
任超杰介绍,胰岛素进入血液前必须保持完整的结构,但有这三道屏障,途中很容易被吸收截停,失去降血糖的作用。这也是胰岛素不能口服,需要注射给药的重要原因。
“提高口服胰岛素生物利用度,关键要提升在消化道中的稳定性和在肠道细胞中的转运效率。”周民说,目前主要有三种技术路线:设计新型递药系统,修饰胰岛素的化学结构以及寻找安全高效的吸收促进剂。
有科研人员发现,胰岛素与低分子量鱼精蛋白共价连接可显著改善肠黏膜层和上皮细胞的通透性,胰岛素-胆酸共价偶联物可借助回肠胆盐转运蛋白被小肠吸收……然而,共价修饰可能会影响胰岛素的生物活性。
就吸收促进剂而言,pH调节剂和酶抑制剂可以帮助多肽抵抗酶的降解,黏液渗透剂使多肽药物通过黏膜屏障。虽然在实验阶段,多种促进剂均有不同程度的效果,但要用于临床,许多问题还有待解决。
比如今年1月,以色列公司Oramed?Pharmaceuticals宣布旗下口服胰岛素ORMD-0801治疗2型糖尿病的三期临床没有达到主要终点和次要终点。这一采用了pH护盾包衣和蛋白酶抑制剂等多种方法的口服胰岛素以失败告终。
“新型递药系统的载体种类多样。”周民介绍,团队设计的递送系统用的海藻酸钠,此前已被广泛应用于纳米粒或凝胶的制备,具有高黏度,可有效隔绝消化酶,还能在近中性和碱性环境溶解,但在酸性环境不溶于水,使胰岛素不被胃酸破坏,更易在小肠被吸收,等于闯过两道屏障。
微藻载药具备产业化优势
当胰岛素几经险阻,借助海藻酸钠凝胶抵挡蛋白酶的“轰炸”和胃酸侵袭后抵达小肠,迎来最后一道屏障——肠道渗透屏障。
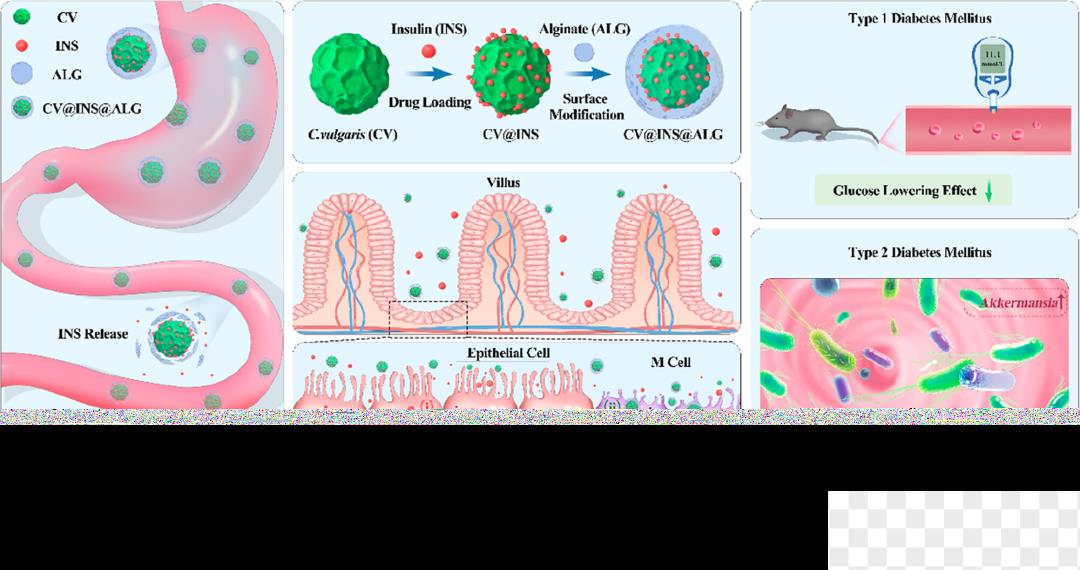
“肠道吸收主要分跨细胞和细胞旁两种途径。”周民介绍,有的研究利用渗透增强剂强行打开肠道上皮间隙,通过细胞旁途径使胰岛素分子通过,存在肠道损伤的风险。此次研究的口服胰岛素递送系统,外覆的海藻酸钠能够粘附在肠壁,延长滞留时间的同时创造出相对安全的递送环境。胰岛素委身于小球藻,又得海藻酸钠庇佑,在肠道能够安全、缓慢地游离出来,通过肠道上皮细胞的胞吞、胞吐进入血液。
任超杰补充道,也有保持完整结构的递送系统被肠道M细胞(可简单理解为肠道的巨噬细胞)摄取并转运到淋巴循环,最终进入血液。两种吸收机制一主一辅、一快一慢,保证该递送系统有效和长期的降血糖作用。
?
该研究中微藻-胰岛素复合口服递送系统介导的两种胰岛素给药方式
此次研究中,团队构建链脲佐菌素诱导的1型糖尿病小鼠模型,发现其口服微藻-胰岛素复合口服递送系统后,体内血糖明显降低,并在12小时内保持稳定水平。与此同时,团队发现长期饲喂载体小球藻和海藻酸钠能够有效改善2型糖尿病小鼠的肠道菌群紊乱,显著提高胰岛素敏感性,改善其胰岛素抵抗情况,并缓解小鼠脏器损害。
此外,团队通过研究微藻-胰岛素复合口服递送系统的体外和体内生物安全性,观察30天内每日口服该递送系统的小鼠,初步验证该递送系统具有良好的生物相容性。
“这一递送系统的可行性已在小鼠上得到验证,且该递送系统具有原料天然、无毒、低成本的优势,可以制成冻干粉末,便于长期储存和运输。”周民表示,但要迈向产业化,还得开展大型动物实验系统地验证。
周民告诉记者,和其他新药研发历程相似,该递送系统要真正变成产品,要经历临床试验、安全性评价等阶段,在此期间,技术改进、风险投资缺一不可。瞄准产业化目标,相关工作正在有序进行。
(科研团队供图)
